E3:弹式热量计校准
目标:测定丁醇butanol样品的燃烧热
概述:
第一部分
组装弹式热量计
第二部分
计算热量计的热容:
第三部分
使用 计算相关样品的燃烧热
第一部分:组装热量计
氧弹价格昂贵,必须小心操作。尤其注意不要刮伤或撞凹闭合表面,也不要损坏螺帽上的螺纹(请轻柔地操作螺帽,以免损坏螺纹的“牙”)。任何拆卸下来的部件都应轻轻地放在组装支架上或干净的毛巾上。
 图 1
图 1
弹式热量计(帕尔设计),图中展示了其绝热夹套,该夹套也可在空置时用作绝热空气夹套。精密水银温度计可由高分辨率电阻温度计或校准过的热敏电阻替代。
Bomb calorimeter (Parr design), shown with an adiabatic jacket, which may also be used empty as an insulating air jacket. The precision mercury thermometer can be replaced by a high-resolution resistance thermometer or a calibrated thermistor.
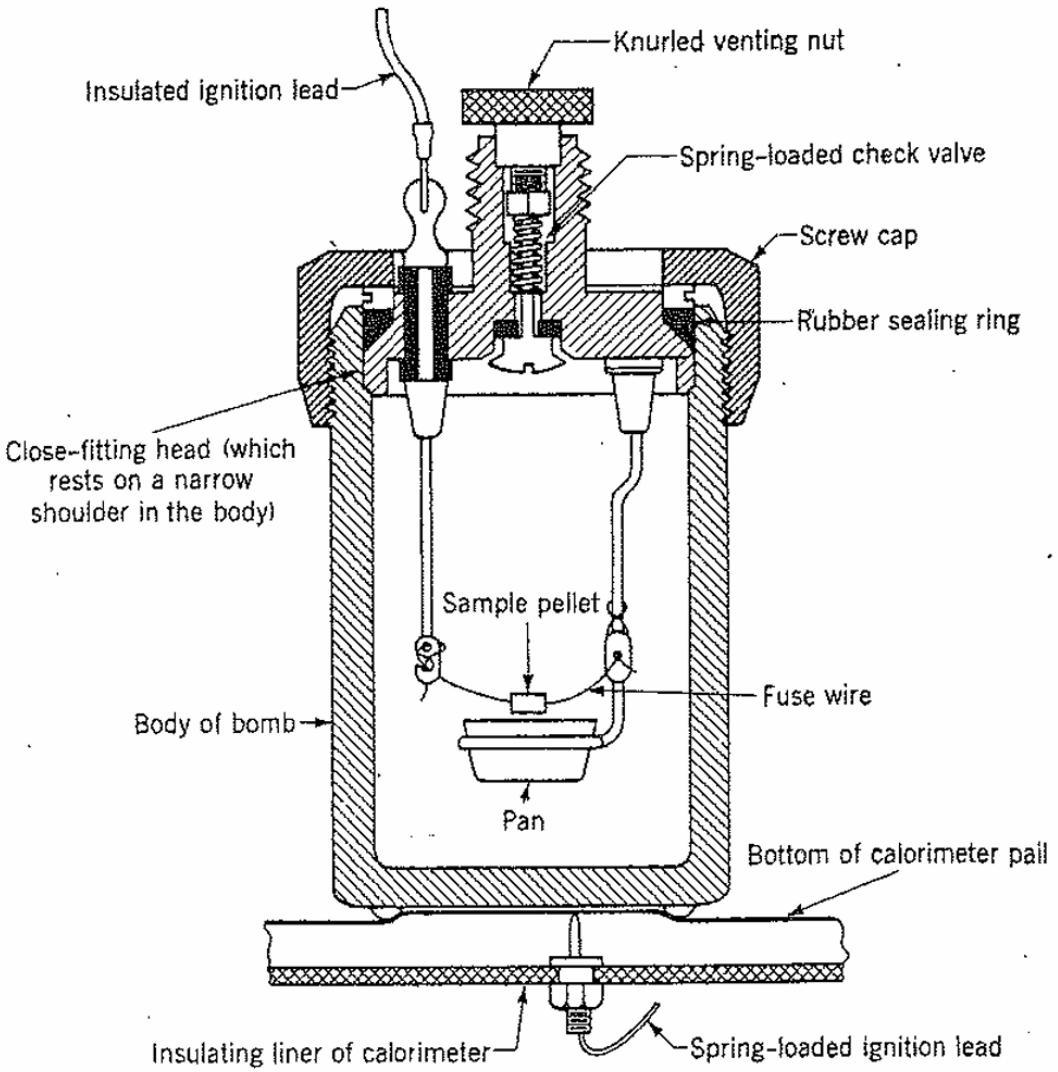
图 2 帕尔单阀氧弹,图中显示其与热量计桶底部接触。其中一个电触点通过桶身自动与氧弹主体连接。在装载样品时,应将氧弹安装在组装支架上。
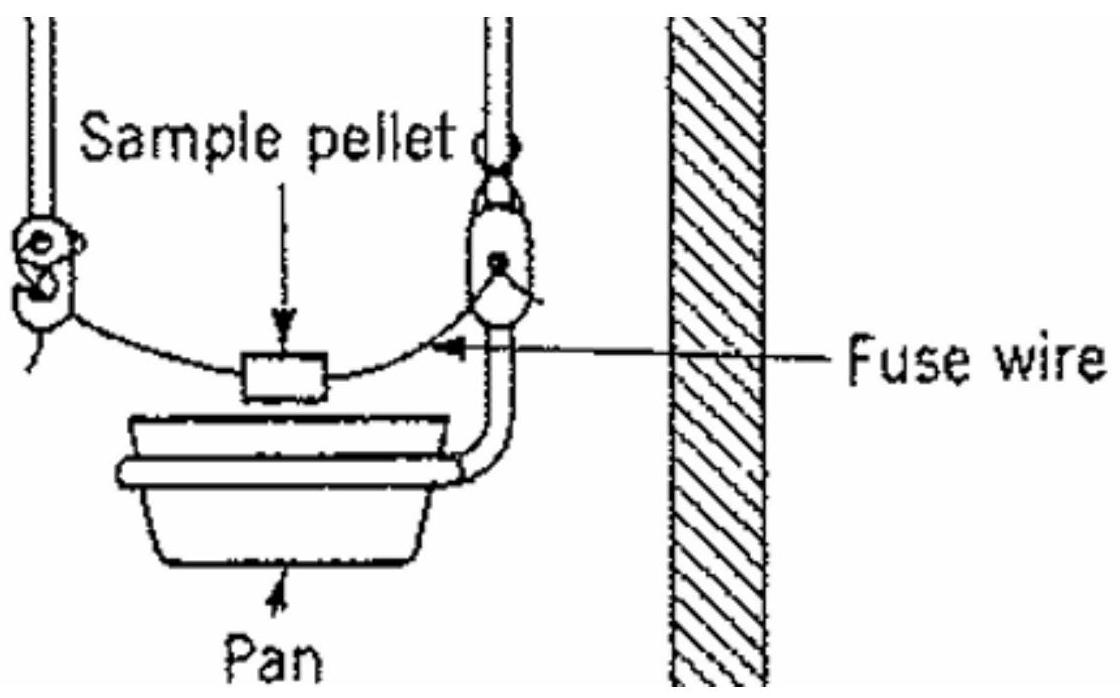
氧弹置于一个 2 升的水浴中。这是为了将氧弹与环境隔离,并防止在实验过程中的热量传递(以维持绝热条件)。氧弹旁边有一个用于显示温度的温度计和一个用于保持水浴****温度均匀的搅拌器。请注意,搅拌器会向系统中引入热量,您会观察到温度缓慢、稳定且呈线性上升。氧弹本身充有高压氧气,并包含一对电极,一根铁丝和样品连接于其上。通过这些电极对铁丝进行电点火,从而引发样品燃烧,样品会在一个小金属坩埚中燃烧:
确保氧弹干燥、清洁,并且在两次实验之间没有残留的铁丝碎屑。确保设备完全清空,并且控制盒上的所有开关都处于关闭状态。
1 操作流程
步骤1
将铁丝剪切至合适长度(确保没有急弯)并精确称重(单位:克)。
步骤2
准备待测物质(约 0.8 克的苯甲酸压片,或约 0.4 克小心加入明胶胶囊中的液体丁醇)。
步骤3
使用 1.5V 干电池提供的电流加热铁丝,将其熔合到物质中。轻轻向铁丝吹气以防过热。压片或胶囊应位于中心位置。
步骤4
仔细称量与铁丝熔合后的样品。
步骤5
小心地安装样品和铁丝。样品应位于坩埚正上方,铁丝应只接触电极。
步骤6
小心地组装氧弹,并用手拧紧螺帽(不要使用扳手)。
步骤7
将氧弹连接到充氧气装置,在拧紧前小心对齐接口。 a. 小心打开氧气主供气阀,缓慢向氧弹充气至 380 psi(不要超过 450 psi)。 b. 释放氧弹内压力,以冲洗掉弹内存在的大气氮。 c. 重新向氧弹充气至 380 psi。
步骤8
将氧弹浸入水中,仔细检查是否漏气。如果存在泄漏,需给氧弹放气,松开并轻微旋转弹头,重新拧紧螺帽,并重复步骤 7。每 秒一个气泡是无关紧要的。
步骤9
擦干氧弹,将其放入干燥的桶内,再将桶放入热量计中,确保其居中且不接触内壁。
步骤10
连接氧弹顶部的电极,并确保连接紧密。
步骤11
用 25°C 的水装满一个 2 升的烧瓶。小心地将水倒入桶中,并让其排尽约 30 秒。 a. 一个便捷的备水方法是同时使用热水和冷水,按需混合两者,边摇晃边用温度计检查,直到烧瓶装满。
步骤12
盖上热量计的盖子,将精密温度计尽可能低地夹住,但不要遮挡刻度。确保夹子不要太紧。桶内温度应在 25°C 的正负半度之内。
步骤13
在控制盒所有开关都关闭的情况下,将搅拌器和点火线的插头插入控制盒。
步骤14
将控制盒插入电源插座。
步骤15
短暂开启搅拌器,确保其运行平稳。
2 进行实验:
热量计现已组装完毕!现在开始读取时间和温度。
步骤1
每 30 秒记录一次时间和温度计上显示的温度,精确到 .001°C。 a. 每次读数前轻敲温度计。在实验结束前不要中断这些读数。务必每 30 秒记录一次时间和温度数据。
步骤2
热量计桶的温度应以非常线性的速率上升(大约每分钟 .001°C)。确保这种稳定的线性增长持续 5 分钟。
步骤3
打开点火开关后立即关闭以点燃氧弹。记录下这一发生的确切时间。 a. 指示灯可能会出现一次短暂的暗闪,这表示有电流通过以烧断铁丝。 b. 燃烧的铁丝将点燃样品,温度将在 秒后上升。 c. 几分钟后,桶内温度应恢复到缓慢而稳定的增长。 d. 不要停止时间和温度的测量。这些测量应持续进行,直到点火后的总时间至少是恢复到稳定速率所需时间的 倍。
步骤4
读数完成后,关闭所有开关并拔掉插头。
3 实验结束后:
步骤1
拆卸装置,小心地释放氧弹****压力,并打开氧弹。
步骤2
取出并称量任何未燃烧的铁丝。 a. 忽略“小球”,除非试图压碎它们时发现是熔融的金属而不是氧化物。
步骤3
用铁丝的原始重量减去未燃烧铁丝的重量,得到燃烧掉的铁丝的重量(单位:克)。
步骤4
如果氧弹内部覆盖有烟灰/黑色粉末,说明点火时的氧气量不足以使其完全燃烧,本次实验应作废。
步骤5
将所有氧弹部件擦拭干净。
第二部分:计算热量计的热容
实验的前几次运行将专门用于计算热量计的热容 。这是通过燃烧我们已知其精确燃烧热的苯甲酸压片来完成的。也就是说,我们使用苯甲酸压片作为样品,执行第一部分的操作流程。通过每 30 秒仔细测量时间和温度,我们应该得到一个大致如下的图表:
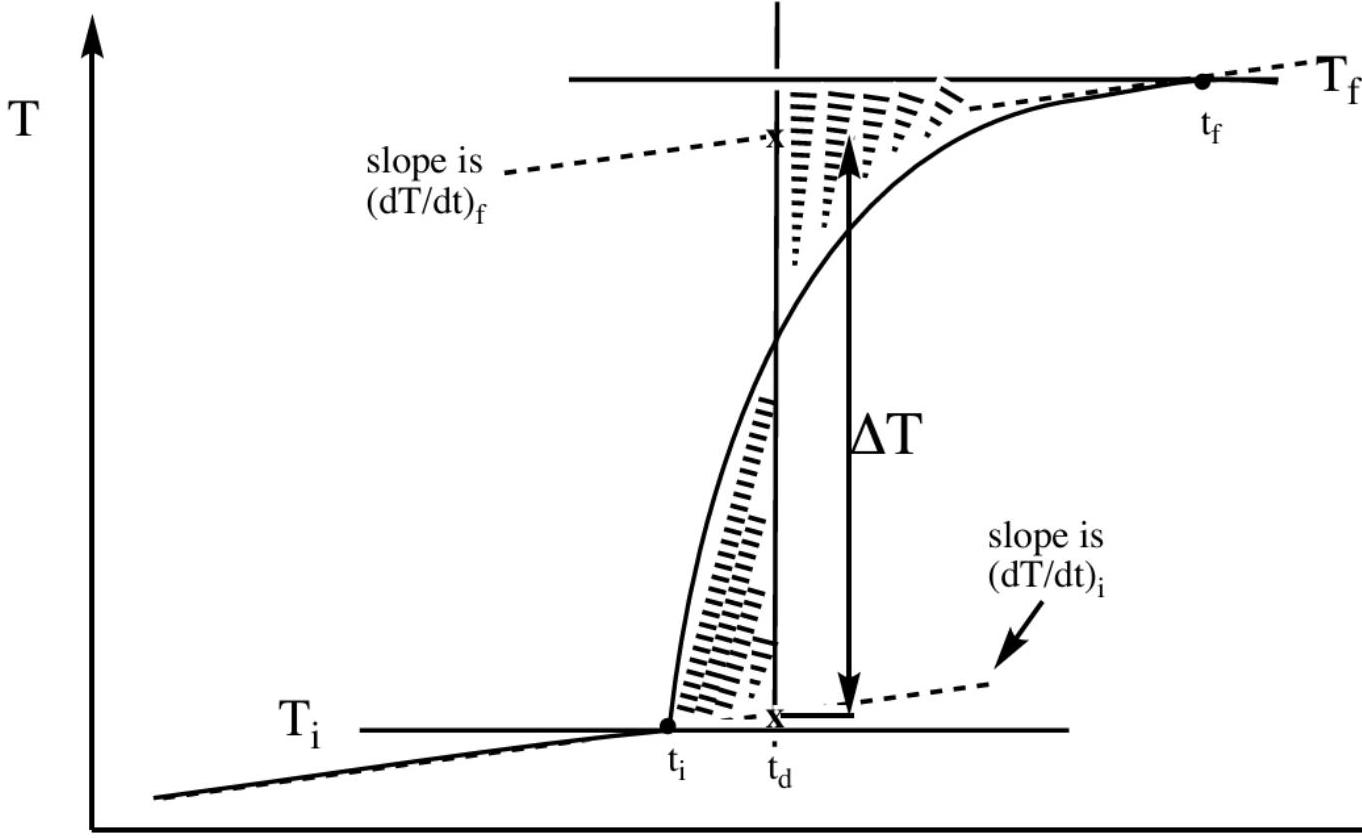
这里, 和 分别表示点火时间和反应结束时间。回想一下,搅拌器向系统中引入了一个恒定的热源,这表现为在时间 时温度缓慢、线性地上升。在 时刻,氧弹被点燃,温度因反应而开始迅速攀升。在某个时间 ,反应结束,温度恢复到仅由搅拌器引起的缓慢、稳定的增长。请注意,初始的线性增长率 和反应后的最终线性增长率 可能不相同(即斜率不同)。 的值应该在实验过程中被精确记录。 的值应通过外推****反应后的数据并将其拟合为线性函数来近似得到(回想一下,我们持续进行时间和温度测量的时间约为反应持续时间的 4-5 倍)。 的值将是反应结束、由搅拌器引起的线性增长开始的时间点(即,它是反应后仍然位于外推直线上的最左侧的点)。
知道 和 的值后,我们现在计算 的值。在上图中,请注意在时间 和 及其相关温度 和 之间的区域,我们可以在数据曲线的上方和下方画出阴影区域。 是使得两个阴影区域面积相等的时间点。也就是说,在时间 和 之间数据曲线下方的阴影区域面积,应等于在时间 和 之间数据曲线上方的阴影区域面积。面积可以通过将数据拟合成函数并进行积分(更难,不推荐,除非拟合函数已知)来求得,或者使用矩形法(更容易)来近似。知道了时间 和 、温度 和 以及斜率 和 的值,我们可以计算出仅由反应引起的温差(不包括来自搅拌器的外部贡献)如下:
现在,利用苯甲酸****燃烧产生的温差,我们可以如下计算热量计的热容:
其中 和 分别是参与反应的苯甲酸和铁丝的质量(记得用原始铁丝质量减去未燃烧铁丝的质量),而 和 分别是苯甲酸和铁丝的燃烧能。
进行 2 次实验,计算每次实验的热量计热容,并使用其平均值。
第三部分:计算丁醇的燃烧热
有了热量计的热容,我们现在就可以测定丁醇样品的燃烧热了。我们需要热量计的热容,是因为这是一个热量计的固有值(即它与所进行的反应无关)。知道了热量计的热容,我们便可以通过求解以下方程来找出丁醇的燃烧能或燃烧热:
求解 ,因为所有其他值都是已知的或可以计算得出。这里,BU 代表丁醇,GE 代表其所在的明胶胶囊。
具体来说,我们重复第一部分的过程,但使用装有液体丁醇的明胶胶囊作为样品。请注意,我们只对丁醇本身的反应感兴趣,所以必须减去明胶胶囊的贡献。明胶的燃烧能为 ,或以国际单位制表示为 。反应引起的温差 的计算方式与第二部分所述相同。
在所有值都已知的情况下,我们可以求解上述方程中的 ,得到丁醇样品的燃烧能,单位为 。要得到燃烧热,我们只需将其单位转换为 。请记住,焦耳到卡路里的转换关系是 。